2012年12月6日小池亮太朗 助教(複雑系科学専攻)2012/11/1着任
2012年11月に着任しました小池亮太郎です。学生時代よりこれまで物理学や計算科学を用いて生物を研究する、生物物理やバイオインフォマティクスの分野で研究を行ってきました。その中でも生物のはたらきに欠かせない蛋白質に強い興味をもって研究を進めています。
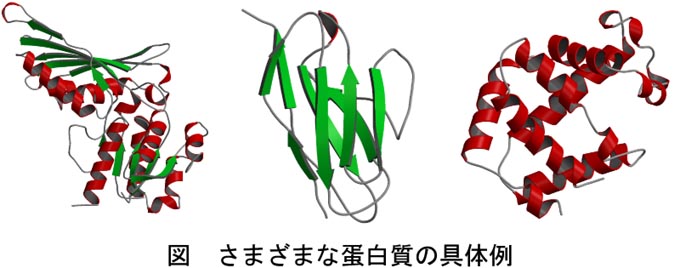
蛋白質の面白さはその多様性にあると私は考えています。20種類のアミノ酸がつらなった分子を一口に蛋白質といいますが、アミノ酸の並び、つまり20種類のアミノ酸をどういう順番でどれだけの数をつなげていくか、を変えることで実に多様な蛋白質が生まれます。 実際の蛋白質の形を下の図で示しますが、アミノ酸の並び(「アミノ酸配列」または単に「配列」と呼ぶ)を変えることで全く違う形(構造)の蛋白質ができあがります。これらは生体内での働き(機能)もさまざまで、アルコールの分解に関わるもの、体内に侵入した異物を認識するもの、酸素を運搬するもの、など多岐にわたります。
ヒトには2~3万程度の遺伝子がありますので、その産物である蛋白質はヒトだけでもそれ以上はあることになります。他の生物種まで考えれば莫大な数の蛋白質が存在することは間違いありません。これらの蛋白質は多くの研究者の手により解析されており、その結果は電子化されてさまざまなデータベースを通して広く公開されています。 (上記の蛋白質の絵もそのようなデータベースの1つであるProtein Data Bank(PDB)より構造の情報を得て作成しています。)この多様性に富んだ莫大な数の蛋白質を、計算機をつかって理解しようというのが私の研究です。
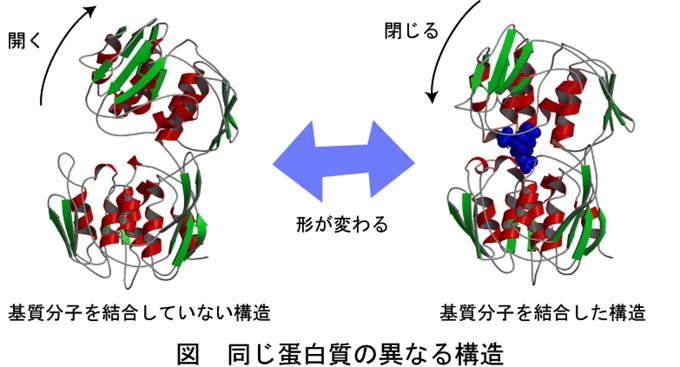
これまで私が取り組んできた研究の中から、蛋白質の構造と機能に関する研究を紹介させてもらいます。この研究では前述のPDBを利用するのですが、上の図のような違う蛋白質の構造を集めるのではなく、同じ蛋白質の違う構造を集めてきます(下図参照)。 これらの構造を調べることである蛋白質が機能するときに構造をどのように変えているのかを調べることができます。PDBからこのような構造を集め、機能と構造変化の関連性を調べることで、蛋白質の特定の機能では構造を大きく変える必要があることを明らかにしました。また、構造情報を入力として受け取り、蛋白質がどのように形を変えるかを調べるプログラムの開発も行っています。
さらに、今後は蛋白質複合体に関する研究にも注力したいと考えています。前述しましたように、生体内では多様な蛋白質が働いているのですが、これらはお互いに相互作用することでより複雑で高度な働き、あるいはシステムと呼べるもの、を実現しています。 この高度なシステムを理解するときの鍵となるのが相互作用であり、その様子は蛋白質複合体の構造を調べることで詳しく知ることが出来ます。この複合体構造を計算機を用いて解析し、生体内で多数の蛋白質により実現されている複雑で高度な働き(システム)の理解を目指します。